Stoikiometri
compiled by: suprapto van plaosan
Persamaan kimia adalah representasi simbolis dari reaksi kimia. Bahan pereaksi (reaktan) diletakkan di sebelah kiri, dan produk ditampilkan di sebelah kanan, biasanya dipisahkan oleh panah yang menunjukkan arah reaksi.
Koefisien numerik di samping setiap entitas kimia menunjukkan proporsi entitas kimia tersebut sebelum dan sesudah reaksi. Hukum kekekalan massa menyatakan bahwa jumlah setiap unsur harus tetap tidak berubah dalam reaksi kimia. Oleh karena itu, dalam persamaan yang seimbang setiap sisi persamaan kimia harus memiliki besaran yang sama dari setiap unsurnya.
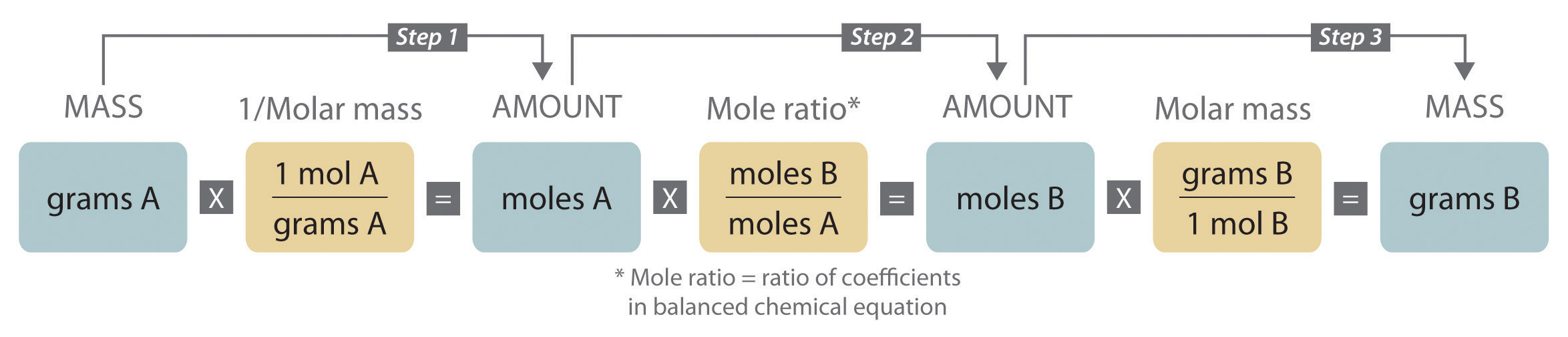
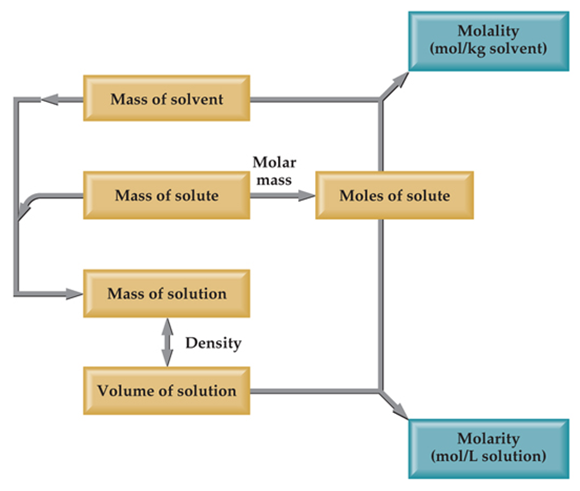
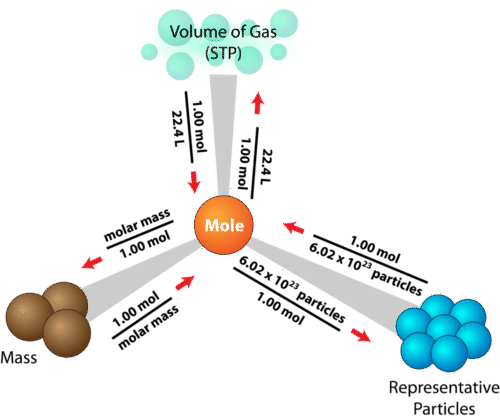
Stoikiometri adalah bidang kimia yang berkaitan dengan jumlah relatif reaktan dan produk dalam reaksi kimia. Untuk reaksi kimia yang seimbang, bilangan bulat (koefisien) digunakan untuk menunjukkan kuantitas (umumnya dalam mol) reaktan dan produk. Misalnya, ketika oksigen dan hidrogen bereaksi menghasilkan air, satu mol oksigen bereaksi dengan dua mol hidrogen menghasilkan dua mol air.
Selain itu, stoikiometri dapat digunakan untuk mencari kuantitas seperti jumlah produk yang dapat diproduksi dengan sejumlah reaktan dan persen rendemen.
Hubungan antara produk dan reaktan dalam persamaan kimia seimbang sangat penting dalam memahami sifat reaksi. Hubungan ini memberi tahu materi apa dan berapa banyak yang dibutuhkan agar reaksi dapat dilanjutkan. Stoikiometri reaksi menggambarkan hubungan kuantitatif antar zat yang terlibat dalam berbagai reaksi kimia.
Dari persamaan reaksi, dimungkinkan untuk menyimpulkan rasio molar berikut:
- 1 mol $C_2H_6$: 2 mol ${CO}_2$
- 1 mol $C_2H_6$: 3 mol $H_2O$
- 1 mol $C_2H_6$: 7/2 mol $O_2$
- 7/2 mol $O_2$: 2 mol ${CO}_2$
- 7/2 mol $O_2$: 3 mol $H_2O$